План заполнения
Команда ИСТОК (филиала МБОУ Чернухинская СШ - Мотовиловская СШ)
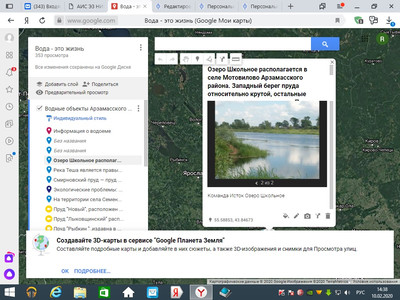
1.Карта Арзамасского района с указанием населенного пункта. (фото карты - 1 балл, вставка скриншота с интерактивной карты - 2 балла, вставка интерактивной карты - 3 балла)
2.Обращение команды к участникам проекта.
Уважаемые участники проекта! Рады снова встрече с вами в рамках проекта с таким красивым названием. Надеемся, что мы сможем узнать что-то новое и желаем всем командам успехов в изучении родного края и удивительного вещества - воды.
3. Фото команды
4. Название команды.
Наша команда - ИСТОК
И - интеллектуальные
С - смелые
Т - творческие
О - образованные
К - креативные
5. Возраст команды, класс. 7-9 класс
6. Состав команды:
Казакова Анастасия, 9 класс - лидер
Воронова Алена, 9 класс - помощник лидера
Комендантов Денис, 9 класс - компьютерный дизайнер
Барбаренко Варвара, 8 класс - исследователь
Гордеева Юлия, 7 класс - фотограф
Купряхина Александра, 7 класс - художник-оформитель
7.Девиз:
Воде дана удивительная сила быть соком жизни на Земле (Леонардо да Винчи).
Люблю тебя, мой край родной, в ИСТОКе - наша сила!!!
8.Эмблема команды (эмблема, взятая из интернета, оценивается в 1 балл)
9. Наш слоган:
Связывают серебрянные нити
Юг и север, запад и восток.
О водных просторах родного края
Расскажет команда ИСТОК!!!
10. Руководитель команды:
Челышева Юлия Николаевна, учитель биологии и химии высшей квалификационной категории
Спирина Марина Владимировна, учитель географии 1 квалификационной категории
Константинова Ирина Александровна, учитель информатики высшей квалификационной категории
филиал МБОУ Чернухинская СШ - Мотовиловская СШ
2 этап - "Вода - это жизнь"
Экологические проблемы оз. школьное, с. Мотовилово Арзамасского района:
1) снижение видового разнообразия организмов, обитающих в данном водоеме;
2) организация незаконных сбросов мусора, загрязнение акватории и прибрежной территории;
3) снижение качества воды, в 2019 году в водоеме по результатам СЭС было запрещено купание, хотя ранее он использовался также и в рекреационных целях;
4) деградация берегов, размыв;
5) превышение восстановительных способностей водоема при хозяйственно-бытовой использовании данного водного объекта (избыточный вылов рыбы, были отмечены случаи мытья автомобилей, оставления органического мусора на берегах - ветки, прошлогодняя листва и т.д.)
Пути их решения:
1) организация санитарных экологических десантов по приведению в порядок береговой линии;
2) проведение просветительских акций и мероприятий, беседы с жителями и отдыхающими,
3) проведение экологического мониторинга качества воды в озере с использованием различных методик (биоиндикация, исследование химических и органолептических показателей и др.).
4) организация экологического патруля совместными усилиями органов местного самоуправления, сельской администрации, родителей, сотрудников ОМВД; при фото/видеофиксации нарушений - отправлять материалы в прокуратуру;
5) расширение спектра использования озера, например, для разведения рыбы и последующего рационального вылова, так, чтобы озеро Школьное могло бы стать личностно значимым для многих жителей села объектом.
Творческое задание - создание ментальной карты
https://www.mindmeister.com/ru/1413835959/_
https://www.mindmeister.com/1413835959?t=PZAqWFBnkc
3 этап
УДИВИТЕЛЬНЫЕ СВОЙСТВА ВОДЫ
| Название опыта | Образование и разложение кристаллогидратов |
| Описание |
Кристаллогидраты - это вещества, в состав которых входит кристаллизационная вода. Например, медный купорос CuSo4·5H2О. При взаимопревращении кристаллогидратов в безводные вещества - например при выпаривании или добавлении воды - могут изменяться их свойства, например, цвет. |
| Гипотеза | Медный купорос и безводный сульфат меди (II) имеют сходный химический состав, отличаясь лишь по наличию кристаллизационной воды. |
| Техника безопасности | Соблюдать осторожность при работе со спиртовкой. Не допускать попадания солей меди на кожу и слизистые. |
| Проведение эксперимента, обсуждение результатов |
1. Сравнить цвет безводного сульфата меди и кристаллов медного купороса. (безводный - белый, медный купорос - ярко-голубой). 2. Растворили кристаллы медного купороса в воде и добавили несколько капель полученного раствора голубого цвета на предметное стекло. Нагрели предметное стекло в пламени спиртовки. Сначала образовывались кристаллы светло-голубого, потом желтовато-белого цвета. |
| Выводы |
1. Взаимопревращения безводных веществ и кристаллогидратов доказывают сходство их химического состава. 2. По признаку изменения цвета можно судить о прохождении химической реакции, при этом вода является одним из реагирующих веществ. |
| Название опыта | Растворение серной кислоты в воде |
| Описание |
В основе современных представлений образования растворов лежит гидратная теория Д. И. Менделеева. Он считал, что растворение – не только физический, но и химический процесс взаимодействия растворенного вещества с растворителем. Об этом свидетельствует выделение или поглощение тепла, изменение объема, окраски и другие явления, протекающие в процессе растворения. Взаимодействие растворенного вещества с растворителем называется сольватация, а в случае водных растворов – гидратация. Процесс растворения включает три основные стадии. 1 Разрушение растворенного вещества до уровня молекул или ионов. Этот процесс требует затраты энергии. 2 Взаимодействие молекул растворителя с частицами растворенного вещества. Сольватация (гидратация) сопровождаются выделением энергии. 3 Равномерное распределение сольватов (гидратов) в растворителе. Является следствием диффузии и требует затраты энергии. |
| Гипотеза | Так как тепловой эффект является признаком химической реакции, то процесс растворения вещества с выделением теплоты доказывает его физико-химическую основу, то есть вода в этих реакциях является одним из реагентов, а не только средой для протекания химической реакции. |
| Техника безопасности | Необходимо соблюдать осторожность при выполнении измерений ртутным термометром. Помни правило: сначала вода, потом кислота, иначе случится большая беда. |
| Проведение эксперимента, обсуждение результатов |
Проводим растворение концентрированной серной кислоты в воде - к дистиллированной воде в химическом стакане при помощи пипетки добавляем 4 мл концентрированной серной кислоты, получаем бесцветный раствор, при этом отмечаем повышение температуры с 22 до 25 градусов (реакция экзотермическая, идет с выделением теплоты). |
| Выводы |
1. Так как наблюдаем тепловой эффект, следовательно произошла химическая реакция, следовательно растворение - физико-химический процесс. 2. При растворении вещества вода выступает в качестве реагента (реагирующего вещества). |